|
Zum besseren Verständnis: - Kurze Erläuterung wichtiger genetischer Fachbegriffe - Einfache Erbschemata für den monogen dominant-rezessiven Erbgang
Auf folgende Krankheiten / Erbkrankheiten wollen wir kurz eingehen:
- Hüftgelenkdysplasie (HD) - CLAD - PRA rcd 4 - Epilepsie - Speiseröhrenlähmung (MO) - Entropium und Ektropium - Magendrehung - Kurze Erklärung genetischer Fachbegriffe
Hüftgelenkdysplasie In der Bekämpfung der Hüftgelenkdysplasie (HD) kann man Erfolge feststellen. In Deutschland trägt die konsequente Auswertung seit einigen Generationen Früchte. Besonders bei jungen Hunden ohne viel Muskelmasse zeigt sich die HD recht früh: Schwierigkeiten beim Aufstehen oder unstete Bewegung. Gewissheit gibt es aber nur durch ein Röntgenbild, denn es gibt Hunde, die gute Hüften haben und „schlacksig“ laufen und andere mit schweren Hüftgelenkschäden, die aber durch Training genug Muskelmasse gebildet haben und bis ins Alter äußerlich unauffällig bleiben. Da die HD mit aller Wahrscheinlichkeit polygen vererbt wird, das heißt, dass mehrere Gene an der Ausprägung des Hüftgelenks beteiligt sind (beim Menschen sind es mittlerweile 17 bekannte Gene), wird es wahrscheinlich nie eine völlig HD-freie Zucht geben können, aber unsere HD-Statistik liest sich positiv. Dennoch beobachten wir mit Missfallen die Auswertungspraktiken einiger Nachbarländer, Hunde in dem Land auswerten zu lassen, in dem es die besten Ergebnisse zu erwarten sind. Ältere Studien haben bereits die Position vertreten, dass Aufzucht und Fütterung eine Disposition auf HD verstärken können. Hier könnten epigenetische Einflüsse mit auf die Hüftgelenkausbildung einwirken. Junge Hunde bis zu einem Jahr sollten ausreichend Bewegung haben. Stundenlange Spaziergänge oder ständiges Treppenlaufen (wenn Müdigkeit einsetzt) wirken sich natürlich auf das Skelett aus. Viel zu eiweißreiche Ernährung führt zu schnellem Knochenwachstum. Kalzium und Phosphat können sich aber nicht in gleichem Maße einlagern und es kommt zu Deformationen. Auch kann sich die Muskulatur, die den Gelenken Stabilität verleiht, nicht in gleichem Maße ausbilden. Deshalb sind Grünlippmuschel-Präparate zu empfehlen, da sie die Einlagerung von Kalzium und Phosphat in die Knochenmasse fördern. In den Ländern der FCI gibt es bezüglich der HD folgende Klassifizierungen: A - Frei B - Verdacht C - Leicht D - Mittel E - Schwer In manchen Ländern wie z.B. in Deutschland richtet sich die Bewertung immer nach der schlechteren Hüfte, in anderen Ländern, wie z.B. der Schweiz, werden beide Hüften getrennt bewertet. Großbritannien hat ein abweichendes Klassifikationssystem, hier wird der Aufbau jeder Hüfte mit einer bestimmten Anzahl von Punkten versehen. Je kleiner die Punktzahl, desto besser die jeweilige Ausprägung. Beide Hüften des Hundes erhalten eine bestimmte Punktzahl. Ein Hund mit der Bewertung 3/3 verfügt über ausgezeichnete Hüften. Von Hunden, die mit 25/25 ausgewertet sind (die in England auch noch zur Zucht verwendet werden), sollte man für die Zuchtverwendung Abstand nehmen. Bei Hunden mit 5/5 oder ähnlicher Kombination (also insgesamt bis 10) gibt es keine Bedenken. Die abenteuerlichen Umrechnungstabellen des englischen Systems in FCI-Auswertungen, die kursieren, weichen die Erkenntnisse der „Hartung Schule“ diesbezüglich auf. Die Tiermedizinische Hochschule Hannover geht bei der Erforschung der HD neue Wege. In einem molekulargenetischen Programm beim Schäferhund wurden sogenannte „Marker“ für die Ausprägung von HD identifiziert. Findet man solche Marker bei einem Hund, ist genetisch die Veranlagung für eine HD gegeben. Ob sich diese wiederum ausprägt, hängt aber auch von äußeren Faktoren ab und lässt sich über einen molekularbiologischen Test nicht vorhersagen. Bei der Zuchtauswahl der Elterntiere könnte ein solcher Test jedoch in Zukunft eine große Rolle spielen. Man ist dabei das Programm auch auf andere Rassen zu übertragen.
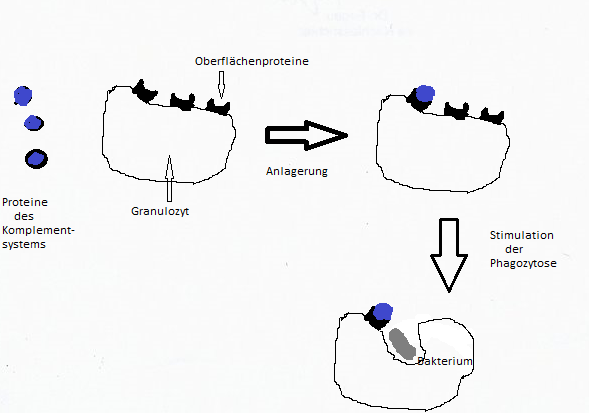
CLAD (=Caniner Leukozyten Adhäsions Defekt) Diese Krankheit ist eine erbliche Immunschwäche beim Irish Setter, die auf einer Funktionsschwäche der Granulozyten beruht. Was sind Granulozyten? Granulozyten gehören zu den kernhaltigen weißen Blutkörperchen, zu den Leukozyten. Diese sind frei im Blut beweglich und sorgen für die Abwehr eingedrungener Erreger (Bakterien, Viren). Sie entstehen im Knochenmark durch die Teilung der dort befindlichen Stammzellen. Normalerweise enthält ein Kubikmillimeter Blut zwischen 5000 und 10000 Leukozyten. Bei einer Infektion erhöht sich die Anzahl auf 20000 bis 30000. Aufgabe der Granulozyten: Sie übernehmen die sog. unspezifische Abwehr gegen eingedrungene Bakterien und Viren. Sie zirkulieren frei im Blut und gelangen so sehr schnell an die Orte, an denen sie benötigt werden. Sie werden über Proteine (=Eiweiße) im Blutserum aktiviert, die in komplizierter Weise mit den Blutzellen zusammenarbeiten und die Phagozytose (das Einschließen bzw. Umschließen der Erreger mit anschließender Auflösung) stimulieren. Diese Proteine werden als Komplementsystem bezeichnet (Komplement=Ergänzung). Die Stimulation erfolgt durch Anlagerung dieser Proteine an bestimmte Oberflächenbereiche der Granulozyten, die ebenfalls durch Proteinstrukturen gebildet werden. Zwei Proteinstrukturen zur Ausbildung dieser Oberflächenstrukturen fehlen bei dieser Krankheit.
Zellen, die Erreger durch Phagozytose aufgenommen haben, können so zerstört und als Eiter ausgeschieden werden. Die unspezifische Abwehr ist vor allem bei Welpen außerordentlich wichtig, da die spezifische Abwehr mit Antikörperbildung noch nicht voll entwickelt ist. Ursachen der Erkrankung: Durch einen „Fehler“ (Mutation) in der Erbinformation werden bei Hunden, die diese Krankheit aufweisen zwei Oberflächenproteine (CD11b und CD18) der Granulozyten nicht ausgebildet. Die Stimulation zur Phagozytose ist deshalb nicht mehr möglich. Als Folge können eingedrungene Bakterien und Viren in der Blutbahn nicht mehr abgefangen werden und vermehren sich deshalb ungebremst. Krankheitssymptome: Die betroffenen Welpen zeigen schon sehr früh Infektionssymptome. Dies reicht von Nabelentzündungen, die nicht abheilen, über zahnfleisch- und Mandelentzündungen bis zu krankhaften Hautveränderungen. Häufig kommen im Alter von 8 bis 14 Wochen Gelenkentzündungen hinzu. Die Knochenbereiche in Gelenknähe werden dicker, behindern so die Bewegung und rufen dadurch eine unsichere, wackelige Fortbewegung hervor. Schreitet die Krankheit fort, ist ein Aufstehen und Fortbewegen oft nicht mehr möglich. Auch ein Anschwellen der Kieferknochen wird als häufiges Symptom beschrieben. Meist sind die Entzündungen mit hohem Fieber verbunden. Behandlungen mit Antibiotika bzw. Cortison zeigen nur kurzfristig Erfolg. Nach dem Absetzen der Medikamente erscheinen die Symptome wieder, sodass am Ende nur noch das Einschläfern der Welpen bleibt. Wie vererbt sich die Krankheit? Bereits 1950 zeigten Untersuchungen des Amerikaners Renshaw an einer 39 Tiere starken Irish Setter – Population, dass die Vererbung von CLAD einem einfachen monogenen autosomal rezessiven Erbgang nach Mendel folgt. Stammbaumanalysen schwedischer Wissenschaftler untermauerten dies. Heute gibt es ein molekularbiologisches Testverfahren, die Deutschland von der Firma LABOKLIN durchgeführt, um Anlagenträger dieser Krankheit zu identifizieren. Eine Verbindung zweier Anlagenträger (Heterozygoten) würde bei einem Teil der Nachkommen (25%) die Krankheit zum Ausbruch kommen lassen, deshalb sind Verpaarungen zweier Anlageträger (Aa) nicht zulässig. Da die DNA-Tests bei Irish Settern schon seit Jahren durchgeführt werden, gilt diese Krankheit als besiegt.
PRA (PRA rcd4) beim Irish Red Setter Seit den 70er Jahren des letzten Jahrhunderts kennt man beim Irish Red Setter das PRA-Problem. Progressive Netzhautatrophie, rcd-PRA, ist eine genetische Störung, die verursacht, dass die Zellen in der Retina (=Netzhaut) im Hintergrund des Auges degenerieren. Bei der bereits länger bekannten Form der PRA rcd1 beginnt diese Degeneration schon im Welpenalter und führt zu einer baldigen Erblindung der betroffenen Tiere. Durch gezielte Verpaarungen und später auch durch DNA-Tests ist diese PRA-Form in der kontrollierten Setterzucht heute nicht mehr existent. Anders verhält es sich bei der neuen Form, genannt PRA rcd4 oder LOPRA (auch dem Englischen „late onset PRA“, also eine spät auftretende PRA-Form). Zuerst scheinen die Zellen hier normal zu wachsen, dann jedoch verlieren sie langsam ihre normale Funktion. Dies führt in der Anfangsphase zur Nachtblindheit, danach erblinden die befallenen Hunde zumeist, häufig erst im Alter zwischen 8 und 10 Jahren. Die Degeneration kann aber durch eine Untersuchung beim Augenspezialisten bereits früher nachgewiesen werden. Zuerst nachgewiesen beim Gordon Setter, bestätigten sich im Frühjahr diesen Jahres die Vermutungen, dass diese Mutationsform auch beim Irish Red Setter existiert. Nachgewiesen wurde dies durch einen DNA-Test, der von Genetikern des Animal Health Trust (AHT) in England (Suffolk) entwickelt wurde. Heute ist dieser Standard und wird bei Irish Settern unter Anderem zur Erlangung der Zuchttauglichkeit gefordert, soweit kein Nachweis der Eltern vorliegt, und wird in Deutschland von der Firma LABOKLIN durchgeführt. Der Vererbungsmodus entspricht der Immunschwächeerkrankung CLAD, es handelt sich um einen rezessiv monogenen Erbgang. Das bedeutet, reinerbig rezessive Tiere sind „krank“, sie werden später mit großer Wahrscheinlichkeit erblinden. Sie tragen den Genotyp aa. Heterozygote, also mischerbige Tiere, tragen das Krankheitsgen in sich, sind aber in ihrem Erscheinungsbild (=Phänotyp) gesund und werden mit Sicherheit auch nicht erblinden – Genotyp Aa. Völlig gesunde Tiere haben das kranke Gen nicht in ihrem Erbgut – Genotyp AA. Will man diese Erbkrankheit nicht im Erbgut unserer Roten anreichern, bedeutet dies für die Zucht: Tiere mit dem Genotyp aa sollten nicht für die Zucht verwendet werden. Mischerbige Tiere mit dem Genotyp Aa sollten nur mit gesunden Tieren (AA) verpaart werden, die Nachzucht einer solchen Verpaarung wird dann zu 50% mischerbige Tiere (Aa), zu 50% aber völlig gesunde Tiere hervorbringen, die dann zur Weiterzucht verwendet werden können. Man sollte diese Erbkrankheit durchaus ernst nehmen, die züchterischen Auswirkungen aber nicht überbewerten, da man durch bewusste Verpaarungen innerhalb kurzer Zeit erbgesunde Tiere zur Weiterzucht erhalten kann. Weiterhin sollte man auch die laufenden Forschungen der Genetiker des AHT mit einbeziehen, da sich bei den untersuchten Tieren in zwei Fällen eine Erblindung weder auf die rcd1-Form, noch auf die rcd4-Form der PRA zurückführen ließ. Vermutlich handelt es sich hierbei um eine weitere, noch nicht beschriebene Mutationsform, die, wenn sie erforscht ist, mit Sicherheit auch in einen DNA-Test mit einbezogen werden kann. Abgesehen davon erblinden im Alter immer noch wesentlich mehr Hunde am Grauen Star als an PRA rcd4.
Epilepsie Die Grundlagenforschung bei der Epilepsie beim Hund steckt im Vergleich zur Forschung in der Humanmedizin noch „in den Kinderschuhen“. Da viele Forschungsarbeiten in der Neurobiologie aber am Tiermodell (also mithilfe von Tierversuchen) durchgeführt werden, ist eine Übertragbarkeit der Ergebnisse aus der Humanforschung durchaus legitim. Hier eine kurze, stark vereinfachte Übersicht: Neben den zahlreichen neuropathologischen und psychischen Faktoren, die Krampfanfälle auslösen können, kennt man heute etwa 21 Gene, die an der Vererbung der idiopathischen Epilepsie beteiligt sind. Diese beinhalten Informationen zur Bildung von Proteinen, die die Informationsübertragung im zentralen Nervensystem regulieren. Die intensive Forschung über mehr als 15 Jahre beim Menschen zeigt aber, dass es für die Mehrheit der Epilepsie-Fälle keine genetischen Ursachen gibt und dass die vererbten Formen auch nicht auf ein Erbschema beschränkt sind. Man kennt Formen von der autosomal dominanten Vererbung (also einer der Elternteile gibt die Krankheit an seine Nachkommen auf jeden Fall weiter), die mitochondriale Vererbung (die krankheitsauslösenden Faktoren werden von der Mutter über die Eizelle vererbt), die x-chromosomale Vererbung (die krankheitsauslösenden Faktoren liegen auf dem X-Chromosom) oder auch rezessive Erbgänge. In Tiermodellen hat sich jedoch gezeigt, dass es häufig multifaktorielle Komponenten sind, die dann auch zu unterschiedlichen Erscheinungsbildern führen können. So kann es durch eine Mutation (genetisch bedingte Veränderung) an einem Teilbereich von Kanalproteinen (Eiweiße, die Kanäle, also Öffnungen in der Außenhülle der Nervenzelle bilden)zu einer Blockade besagter Kanäle und einer damit verbundenen, fehlerhaften Informationsübertragung kommen (ähnlich wie bei der Entstehung von Migräne z.B.), andererseits sind aber auch Varianten möglich, die diese Kanäle ständig offen halten und es so zur Übererregung der Nervenzellen und zu einem synchronen „Informationsfeuern“ kommt, eben zu dem besagten „Gewitter im Gehirn“. Interessant ist in diesem Zusammenhang aber auch, dass zahlreiche „de novo - Mutationen“ gefunden wurden, das heißt, Veränderungen, die sich entweder erst bei der Bildung von Keimzellen ergeben oder auch erst während der Embryonalentwicklung auftreten können. In diesen Fällen sind die Eltern an der Ausprägung solcher Epilepsie-Formen unbeteiligt. Am häufigsten zeigten sich aber Fälle von postnatalen, also erst nach der Geburt eingetretenen Veränderungen sogenannter Kalium-Ionenkanäle, die zu einer Verhinderung, Dämpfung oder Absenkung hemmender Aktionen der Nervenzellverschaltungen führen und so wiederum die oben beschriebene Übererregung auslösen. Hierbei spricht man dann von syndromaler Epilepsie oder einfacher von Krampfanfällen, die aber eine andere Ursache haben und nur begleitend (komorbid) mit anderen Krankheitsbildern einhergehen. Hierzu zählen Fehlbildungen oder Störungen des Stoffwechsels, auch des Stoffwechsels der Mitochondrien, der sog. „Kraftwerke der Zelle“, also Zellbereiche (Zellorganellen), die für den Energiestoffwechsel zuständig sind. Auch Veränderungen der Großhirnrinde oder Syndrome, die mit Lernschwierigkeiten und kognitiven Beeinträchtigungen verbunden sind sowie Migräne können von Krampfanfällen begleitet werden. Lernen heißt immer, also auch beim Hund, Umweltreize und Erfahrungen erfassen, verarbeiten und „abspeichern“. Umwelteinflüsse, die von allen Sinnesorganen wahrgenommen werden, gelangen an die unterschiedlichen Zuständigkeitsbereiche im Gehirn, werden dort verarbeitet, interpretiert und auch abgespeichert. Diese Prozesse verlaufen in geregelten, vorgegebenen Nervenbahnen. Manchmal werden „Lernbahnen“, die normalerweise geordnet verlaufen, unkontrolliert und schlagartig stimuliert. Auch dies führt zu besagtem „Gewitter im Gehirn“, einem Krampfanfall. Was ist also die Schlussfolgerung? Krampfanfälle sind häufig eben nicht erblich bedingt, es gibt eine große Anzahl unterschiedlicher Ursachen. Dabei bedarf es auch beim Hund immer eines Auslösers, das heißt, eines (Umwelt)-Reizes, der zu solchen „Kurzschlüssen im Gehirn“ führt. Wichtig ist es, die auslösenden Faktoren zu kennen. Manche dieser Ursachen können durch die Tiermedizin diagnostiziert werden: Hormonelle Ursachen(z.B. Schwankungen des Blutzuckerspiegels, falsche Konzentration von Geschlechtshormonen, gestörter Ionenhaushalt), Stoffwechselerkrankungen, z.B. auch Lebererkrankungen, anatomisch- pathologische Veränderungen (Tumore, Geschwulste), traumatische Erfahrung als Auslöser. Tierärzte vermuten, dass z.B. auch Stress ein solcher Auslöser sein kann, dies wird uns von der humanmedizinischen Forschung bestätigt. Diese Liste lässt sich beliebig verlängern. Wenn die Ursachenforschung abgeschlossen ist und zu keiner Diagnose geführt hat, gehen Fachleute von einer vererbten Disposition, also einer erhöhten Wahrscheinlichkeit, dass die Krankheit auftreten kann. Leider wird ein Krampfanfall oft zu voreilig für eine erbliche Epilepsie gehalten, die es natürlich auch beim Hund gibt und die man nicht wegdiskutieren kann. Auch beim Hund bestätigen die neuesten Forschungen, dass es keinen einheitlichen Erbgang der idiopathischen Epilepsie gibt. Am häufigsten wird ein polygener Erbgang vermutet. Und hier beginnt die Schwierigkeit für den Züchter. Konkrete Aussagen über das Risiko beim Auftreten von Epilepsie bei einer Verpaarung lassen sich schwer treffen. Man sollte aber beachten, dass gehäuftes Auftreten von Epilepsien in bestimmten Linien auf eine idiopathische Epilepsie schließen lässt und dass eine Weiterzüchtung dieser Linien nicht sinnvoll ist. Generell gilt jedoch: ohne einen entsprechenden Auslöser tritt die Krankheit nicht auf. Studien bei Menschen haben gezeigt, dass Auslöser, die gezielt verabreicht werden (z.B. kurze, bewusst nicht wahrnehmbare Lichtblitze) auch ohne nachweisbare Disposition bei 80% der zufallsmäßig ausgewählten Probannten nach einer bestimmten Zeit Krampfanfälle auslösen. Deshalb sollte man die Sache nicht nur vorschnell auf die Genetik „schieben“, sondern eben auch Ursachenforschung betreiben, sich auf die Suche nach Auslösern zu begeben. Hierzu ist es notwendig Daten und Fakten zu sammeln, zu vergleichen und auszuwerten. Wir wissen noch viel zu wenig über die Gefühlswelt der Hunde im Zusammenleben mit dem Menschen oder über missverständlich entstandene Stress-Situationen. Die neuesten Erkenntnisse über die Erforschung von Spiegelneuronen (spezielle Verschaltungen von Nervenbahnen im Gehirn, die für das Einfühlungsvermögen des jeweiligen Individuums zuständig sind) beim Menschen haben ergeben, dass es eine größere Übereinstimmung der Verschaltungen zwischen Mensch und Hund gibt als zwischen Mensch und Schimpanse, obwohl mit letzterem 98% genetische Übereinstimmung besteht. Der Hund kann also unsere Gefühlswelt verstehen, ist damit aber auch dem Risiko einer potentiellen Überforderung ausgesetzt. Wichtig wäre zu wissen, welche Stress-Situationen zum Beispiel Anfälle auslösen. Bekannt sind Überforderungen bei Arbeitshunden, Sexualstress bei Rüden, Trennungsstress (wenn Menschen Koffer für den Urlaub packen und der Hund bereits die Erfahrung gemacht hat, er kann nicht mit). Doch es wird in einem Hundeleben noch viele weitere belastende Situationen geben. Solange es keine zielgerichteten molekularbiologischen Verfahren gibt, die eine idiopathische Epilepsie eindeutig nachweisen, ist die Suche nach den Auslösern von Krampfanfällen für den Hundehalter mit Sicherheit von großer Bedeutung. Dies ist als eine Art Prophylaxe zu sehen. Kennt man die Auslöser, kann man sie unter Umständen gezielt vermeiden. Und wenn man dadurch nur die Anzahl der Anfälle verringern kann, erspart man sowohl Hund als auch Mensch viel Leid.
Megaösophagus (MO) Schon vor einigen Jahrzehnten hatten wir hehre Ziele. Die Ermittlung des Vererbungsmodus der Speiseröhrenlähmung (Megaösophagus oder kurz MO) sollte durch Einbeziehung der Wissenschaft (Uni Heidelberg und Berlin) angegangen werden. Jahre später mussten wir feststellen, dass die Erfolge bescheiden waren, da wissenschaftliche Forschung sehr teuer ist und bei polygenen Erbkrankheiten wie MO „in den Kinderschuhen steckt“. Die Zusammenarbeit mit den Züchtern gestaltete sich schwierig. Durch das Einschicken der verstorbenen Welpen an die Uni Berlin war das Problem längst nicht behoben. Auch die vom niederländischen Club eingeführte Methode der Käuferbefragung, zum Beispiel „Wie füttern Sie Ihren Hund? Frisst er erhöht vom Tisch? Ist die Nahrung fest oder breiig?“, konnte diese Erbkrankheit nicht ausrotten. Das Einzige, das ich erreicht hatte, war, die Sensibilität der Züchter für dieses gravierende Problem zu fördern. In Erinnerung wird mir ewig der zehnseitige Brief einer Züchterin über das qualvolle Sterben von zehn Welpen an MO bleiben. So etwas geht einem nicht mehr aus dem Kopf. Symptome der Erkrankung: Bei dieser Krankheit fehlt die Innervierung der Speiseröhre gänzlich oder teilweise (degenerative periphere Neuropathie). Die erste Form zeigt sich gleich nach der Geburt. Beim Trinken fließt bei den Welpen Milch aus der Nase, da diese durch die fehlende Peristaltik der Speiseröhre nicht in den Magen transportiert werden kann. Weil die Welpen aber bei einer etwas weniger stark ausgeprägten Form etwas Milch aufnehmen können, bleiben sie am Leben. Ihr Zustand verschlechtert sich jedoch täglich. (Häufig kommt eine Lungenentzündung hinzu, da die nicht abgeschluckte Milch in die Atemwege gelangt.) Nach dem Trinken ist ein starkes Röcheln zu hören. Es ist bei der Diagnose Vorsicht geboten, da gesunde, gierig trinkende Welpen sich ebenfalls verschlucken können. Der entscheidende Unterschied ist nur, dass bei diesen nach kurzer Zeit das Röcheln aufhört und sie nach dem Trinken ruhig schlafen. Es zeichnet sich ab, dass die genetisch bedingte Form dieser Krankheit polygen vererbt wird. Eine komplementäre Ausprägung (bei beiden Elternteilen müssen passende Teilstücke vorhanden sein) ist dabei am wahrscheinlichsten. Eine zweite Ausprägung mit ähnlichen Symptomen( persistierender rechter Aortabogen , PRA) offenbart sich erst mit der Aufnahme von festerer Nahrung (nicht zu verwechseln mit der „echten“ (kongenitalen Speiseröhrenlähmung).Der Welpe kann den dickeren Futterbrei nicht schlucken und wird verzweifelt eine Ecke suchen um diesen wieder herauszuwürgen. Bei Züchtern ist diese Variante als „Rechts – Aorta“ bekannt. Es ist eine Missbildung der Aorta, die sich normalerweise aus der 4. linken Kiemenbogenarterie des Embryos bildet, und normalerweise ohne Probleme an der Speiseröhre vorbeiführt. Entwickelt sich die Aorta aus dem rechten 4. Kiemenbogen, schnürt sie allmählich im Herzbereich die Speiseröhre ein und es kommt zu den gleichen Symptomen wie der MO. Da die Milch aber diese Stelle noch passieren kann, wird der Defekt erst bei Aufnahme von etwas festerem Futter bemerkbar. Ein Röntgenbild wird für Klarheit sorgen. Hier kann man jedoch nicht zwingend von einer genetisch bedingten Krankheit ausgehen, sondern von einer angeborenen Erkrankung, die im Verlauf der Embryonalentwicklung zu der geschilderten Missbildung führt. Es ist anzunehmen, dass auch Frühgeburten mit nicht vollständig abgeschlossener Entwicklung davon betroffen sein können. Ähnliche Symptome wie bei einer Speiseröhrenlähmung sind z.B. bei einer Überreizung des „Nervus Phrenicus“, der für die Innervierung des vegetativen Nervensystems im Hals- und oberen Thoraxbereich zuständig ist, oder z.B. bei einer Entzündung der Speiseröhre festzustellen. Es ist also nicht leicht zu diagnostizieren, welches der Auslöser der Symptome ist. Auch lernt der Hund beim Verabreichen von breiiger Nahrung mit Dilatationen der Speiseröhre umzugehen. Wenn aber mit Hunden, die genetisch bedingte Formen der MO (kongenitale MO) aufweisen, weitergezüchtet wird, sind die Folgen verheerend. Gewissheit schafft meist ein Röntgenbild, leider erst häufig nach der 5. Woche. Oben genannte Entzündungen sind dadurch leider nicht feststellbar. Dem Welpen werden in der Tierarztpraxis weiche Futterkügelchen vermischt mit Kontrastmittel verabreicht. Danach wird er sofort geröntgt. Eine gesunde Speiseröhre hat die Breite eines Bleistifts und der weiße Brei ist bereits im Magen. Eine kranke Speiseröhre ist partiell oder total „ausgebeult“ und der Brei ist noch nicht abgeschluckt. Der Erfolg chirurgischer Eingriffe bei einem Speiseröhrenlähmung, egal welcher Ursache, ist äußerst fraglich. Bei Formen mit nicht erblichen Ursachen beschreibt die Literatur jedoch auch die Möglichkeit einer spontanen Rückbildung der Symptome nach Abklingen der Entzündungs- bzw. Reizungserscheinungen. Nach Forschungen tiermedizinischer Hochschulen liegt der Anteil der erworbenen Formen der MO zwischen 17 und 20%. Ein guter Tierarzt wird die richtige Entscheidung treffen. Insgesamt ist es also wichtig bei dieser speziellen und komplexen Erkrankung den richtigen Tierarzt zu konsultieren, bevor es zu einer Euthanasie des Welpen kommt.
Entropium und Ektropium Erbkrankheiten, die immer wieder auftauchen und wenn man glaubt sie wären passé, gibt es alle zehn Jahre mal wieder eine Überraschung. Erscheinungsbild: Ungefähr im Alter von 6 Wochen, dreht sich bei den Welpen das untere Augenlid mit einer Wölbung nach innen und die kleinen Haare scheuern auf der Hornhaut. Es kommt zu starkem Tränenfluss. Durch einen gekonnt vorgenommenen chirurgischen Eingriff kann ein Tierarzt den Fehler beheben. Wird zu viel des Augenlids entfernt, führt dies zum gegenteiligen Effekt: Ektropium. Das untere Lid stülpt sich nach außen. Gerötete Pupillen und Augenentzündungen bei m kleinsten Windzug sind die Folge. Ektropium kann aber ebenfalls als Erbkrankheit ab der 6. Woche in starker oder weniger starker Ausprägung auftreten. Auch hier schafft ein operativer Eingriff Abhilfe. Aber gerade dadurch sind beide Defekte so schwer zu eliminieren. Da nach einer gelungenen Operation nur für das geübte Auge die Einstiche der Naht zu erkennen sind, werden diese Hunde manchmal verantwortungslos zu Zucht verwendet und der Teufelskreis beginnt von neuem. Beide Formen können vereinzelt in der Wachstumsphase auch verspätet auftreten und in Ausnahmefällen auch die Folge einer Verletzung sein. Mit großer Wahrscheinlichkeit liegt hier bezüglich des Vererbungsmodus eine komplementäre Polygenie vor. Besonders Entropium tritt manchmal auf, wenn man zwei Linien zusammenführt, die jede für sich von der Krankheit nicht betroffen zu sein scheinen, durch neue - passende -Ergänzungsstücke diese aber wieder zum Ausbruch kommt.
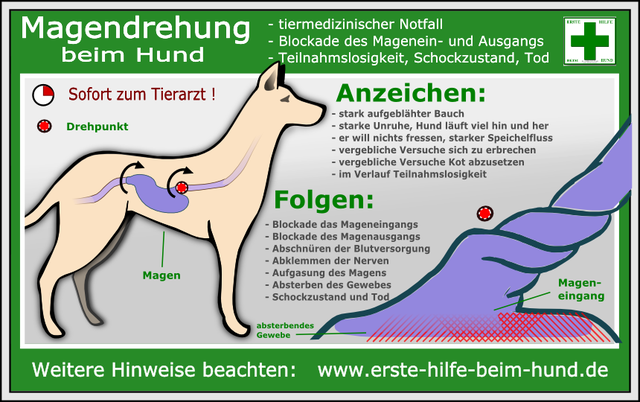
Magendrehung Bei den Roten besonders in England gefürchtet, aber auch bei uns nicht neu.
Symptome: Durch Gasbildung bläht sich der Magen auf und vollführt eine Drehung, Ein-und Ausgang werden verschlossen, die Blutversorgung wird unterbrochen, Nerven sterben ab. Ein aufgeblähter harter Bauchraum, der sich zunehmend trommelartig vergrößert, starker Speichelfluss, Versuch von Erbrechen und Absetzen von Kot, gekrümmter Rücken, unruhiges Hin- und Herlaufen, Kreislaufprobleme etc.
Schnelle Hilfe ist nötig, da jede Minute zählt. Ein erfahrener Tierarzt kann durch eine gekonnte Operation den Magen in seine Ausgangsposition zurückbringen und fixieren. Folgende vorbeugende Maßnahmen sind sinnvoll: 2x täglich füttern, jeweils gefolgt von einer ausgiebigen Ruhephase. Futter vorher einweichen, kein Trockenfutter. Verdorbenes, gärendes Futter entsorgen und dem Hund nicht erneut vorsetzen. Das Trinken von schmutzigem Wasser unterbinden. Aufnehmen von Aas oder verdorbenen Lebensmittel auf Spaziergängen unterbinden. Nach einem Spaziergang oder Training zuerst nur eine geringe Wassermenge zum Trinken anbieten. Ursachen: Man vermutet ein Zusammenwirken mehrerer auslösender Faktoren. Häufig sind größere Hunde mit tiefem Brustkorb betroffen (also auch der Irish Setter), da bei diesen der Magen Platz hat eine Drehung durchzuführen. Da vorwiegend ältere Hunde (ab ca. 2 Jahren) davon betroffen sind, geht die Wissenschaft von einer Bindegewebeschwäche der den Magen befestigenden Bänder aus. Diese kann altersbedingt sein, es gibt offensichtlich aber auch genetische Dispositionen. Ein Zusammenhang zwischen Speiseröhrenlähmung und Magendrehung ist nicht auszuschließen. In einer schlaffen, geweiteten Speiseröhre mit Futterresten können sich Gase bilden zu einer Aufblähung und eventuellen Drehung führen. Leider sind auch Fälle bekannt, bei welchen alle Vorsichtsmaßnahmen eingehalten wurden und eine Magendrehung trotzdem erfolgte. Nach Aussagen unseres Tierarztes sind es dann oftmals verschluckte Gegenstände, die während einer Notoperation zum Vorschein kommen. Die Palette reicht hier von Socken und Strümpfen bis Plastikspielzeug. Also ist auch hier Vorsicht geboten. Einfache Erbschemata zum monogen dominant-rezessiven Erbgang
Gen für die Ausprägung eines Merkmals: A = gesundes Allel a = krankes Allel
1.
Genotypen der Eltern: AA x aa Keimzellen der Eltern A A a a Kombinationsmöglichkeiten Aa Aa Aa Aa alle daraus folgenden Genotypen der Keimzellen, alle Nachkommen sind bezüglich dieses Merkmals gleich.
2. Genotypen der Eltern: Aa x Aa Keimzellen der Eltern A a A a Kombinationsmöglichkeiten AA Aa Aa aa alle daraus folgenden Genotypen
der Keimzellen die Nachkommen sind zu 25% gesund (AA), zu 50% Anlagenträger (Aa) und zu 25% krank (aa)
3.
Genotypen der Eltern: AA x Aa Keimzellen der Eltern A A A a Kombinationsmöglichkeiten AA AA Aa Aa alle daraus folgenden Genotypen
der Keimzellen alle Nachkommen sind phänotypisch gesund, die Hälfte ist Anlagenträger. Die Prozentangaben entsprechen der Wahrscheinlichkeit des Auftretens, bedingt durch die freie Kombination der Keimzellen bei der Befruchtung können diese bei den Nachkommen eines Wurfes jedoch variieren. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||